Tujuan
Membuat asam pikrat dengan reaksi substitusi elektrofilik Aromatik
Teori Dasar
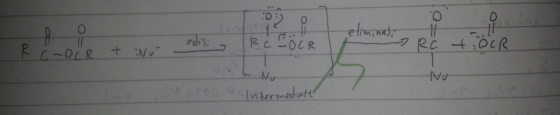
Reaksi substitusi elektrofilik terjadi pada senyawa aromatis, tidak hanya pada senyawa monosiklik seperti benzena tetapi juga pada senyawa aromatis polisiklik seperti naftalena dan senyawa heterosi atomis seperti furan, pirol, dan tiofena. Reaksi substitusi elektrofilik diakibatkan oleh ion positif. Hal ini dapat terjadi karena penjelasan ini. Elektron yang terdelokalisasi ter-exposed di bagian atas dan bawah dari bidang planar molekul karbon berada.
![sintesis asam pikrat]()
Alat dan Bahan
- Labu bulat
- Kondensor
- Corong buchner
- Penangas air
- Fenol
- Asam sulfat pekat
- Asam nitrat pekat
Cara Kerja
- Siapkan labu bulat, masukkan fenol 7,5 gr. tambahka asam sulfat pekat 20 mL (hati hati dengan fenol, lihat disini), kocok, panaskan campuran dalam penangas hingga mendidih 0,5 – 1 jam, amati perubahan campuran menjadi jernih yaitu terbentuknya asam fenol sulfonat.
- Dinginkan dengan ice bath, tambahkan asam nitrat 22 mL. Kocok 1-2 menit. Terbentuk gas kemerahan
- Panaskan kembali dalam penangas 2 jam
- Tambah air 50 mL, dinginkan dengan ice bath , saring dan cuci dengan air
- Pindahkan kristal. Lakukan rekristalisasi dengan air:etanol (2:1), dinginkan kembali
- Hitung massa
Data Pengamatan
Fenol + H2SO4 +pemanasan –> Larutan jenuh
Campuran +HNO3 –> timbul gas merah
Dipanaskan kembali –> larutan coklat dan berbusa
Endapan = 7,92 gr – 0,95 gr = 6,97 gr
Perhitungan
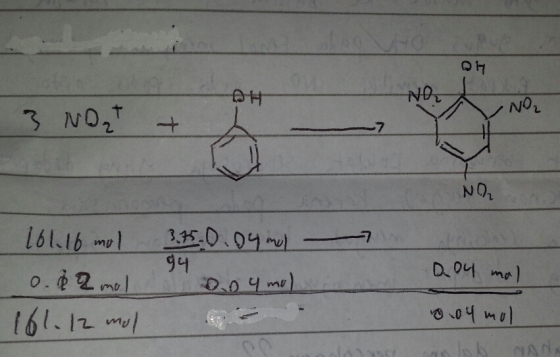
HNO3 + H2SO4 ——–> HSO4- + NO2- + H2O
M :161,16 mol 182,1 mol – – –
R : 161,16 mol 161,16 mol 161,16 mol 161,16 mol 161,16 mol
S ; – 20,94 mol 161,16 mol 161,16 mol 161,16 mol
didapat dari :
M= (% x 10 x ρ ) / Mr
M HNO3 = 65 x 10 x 141 / 63 = 14,65 mol/mL
M H2SO4 = 97 x 10 x 1,84 / 98 = 18,21 mol/mL
mol HNO3 = M x V = 14,65 x 11 =161,16 mol
mol H2SO4 = M x V = 18,21 x 10 = 182,1 mol
![sintesis asam pikrat]()
massa teoritis = 0,04 mol x 229 gr/mol = 9,16 gr
% kesalahan relatif = |(6,79 – 9,16)/9,16| x 100% = 25,87%
% Yield = |6,79/9,16| x 100% = 74,13%
Pembahasan
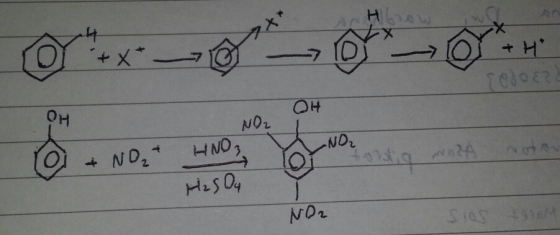
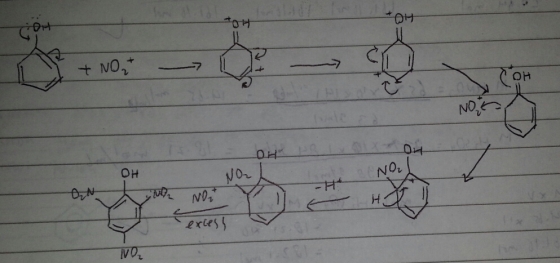
Pada praktikum ini. Dilakukan percobaan yang bertujuan mensintesis asam pikrat dengan reaksi substitusi elektrofilik aromatik. Reaksi yang terjadi merupakan nitrasi, nitrasi merupakan suatu reaksi substitusi elektrofilik dimana terjadi reaksi substitusi atom H pada benzen oleh gugus nitro
Hal yang dilakukan pada praktikum ini ialah fenol disiapkan sebanyak 3,75 gr. lalu dicampurkan dengan H2SO4 pekat. Pekerjaan ini harus dilakukan di lemari asam. Fungsi H2SO4 pekat. Pekerjaan ini harus dilakukan di lemari asam. Fungsi HNO3 pekat ini ialah sebagai katalis dan dipanaskan. Kemudian diberi HNO3 pekat, akan timbul gas kemerahan, reaksinya:
HNO3 + H2SO4 –> HSO4- + NO2+ +H2O
Gas yang terbentuk tersebut ialah NO2+. gas tersebut dihilangkan dengan pengocokkan sampai tidak timbul gas lagi. Fungsi penambahan HNO3 untuk penghasil NO2+ yang dipakai untuk reaksi nitrasi. Kemudian di refluks selama 2 jam. Pemanasan ini dimaksudkan untuk mempercepat reaksi nitrasi, reaksinya :
![sintesis asam pikrat]()
Menurut mekanismenya, gugus NO2 yang masuk ke dalam fenol berada pada posisi orto dan para. Karena gugus OH pada fenol merupakan penunjuk orto dan para sehingga asam pikrat memiliki NO2 pada posisi orto dan para.
Asam Pikrat yang didapat berwarna coklat, seharusnya yang didapat berwarna kuning. Hal ini kemungkinan terjadi karena pada pemanasan pertama, suhu terlalu tinggi sehingga reaksinya menjadi tak berjalan seperti seharusnya. Selain itu % kesalahan relatif yang didapat menunjukkan kesalahan dari prosedur
Kesimpulan
- massa asam pikrat percobaan : 6,97 gr
- % kesalahan relatif : 25,87 %
- Reaksi nitrasi merupakan reaksi substitusi elektrofilik
Daftar Pustaka
- Tim KBI Organik. 2011. Diktat Praktikum Sintesis Organik. Depok : Dept. Kimia FMIPA UI
- Fessenden & Fessenden. 1982. Kimia Organik ed.3. Jakarta : Erlangga
- Sykes. Peter. 1989. Penuntun Mekanisme Reaksi Kimia Organik. Jakarta : Gramedia
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()